Simbolo C ;
peso atomico 12 ;
numero atomico 6 ;
non metallo
Il carbonio
![]()
Simbolo C ;
peso atomico 12 ;
numero atomico 6 ;
non metallo
Il
Carbonio è un elemento molto diffuso in natura sia allo stato
DIAMANTE
E'
la sostanza più dura che si conosca, capace di tagliare il vetro con facilità.
Ha un potere rifrangente molto elevato, che viene
Il
diamante BRUCIA producendo anidride carbonica. Una costosissima esperienza fu
realizzata da Lavoisier nel 1772: egli si associò ad altri chimici per
comperare un diamante che venne riscaldato a contatto con l'aria, in un
recipiente chiuso, fino alla sua totale trasformazione in anidride
carbonica. Egli dimostrò così che il diamante ha
composizione simile a quella dell'umile carbone che si ricava dal
legno.
GRAFITE
Sostanza
opaca e untuosa al tatto. E' TENERA e viene usata per
fabbricare le mine delle matite. Pur non essendo un metallo
la grafite conduce bene la corrente elettrica e il calore: per questo
viene usata per costruire elettrodi e crogiuoli resistenti alle alte
temperature.
Il
diamante e la grafite sono carbonio allo stato puro, ma il
carbonio si trova in natura anche allo stato non puro e combinato con altri
elementi.
Il CARBON FOSSILE
ad esempio può essere costituito da grosse
percentuali di carbonio. Esso si trova in enormi giacimenti formatisi
con la lenta carbonizzazione, fuori dal contatto
con l'aria, di vegetali appartenenti a remote epoche geologiche.
Durante il processo di carbonizzazione la CELLULOSA delle piante, che è
costituita da Carbonio, Ossigeno e Idrogeno, perde parte dell'Ossigeno e
dell'Idrogeno e si trasforma in carbonio quasi puro.
Il CARBONE ARTIFICIALE può essere ottenuto bruciando cataste di
legna coperte di terra per diminuire il contatto con l'aria al fine di
evitare la completa combustione. Ciò che si ottiene è il cosiddetto
carbone di legna che in tempi passati era usato come combustibile per
cucina.
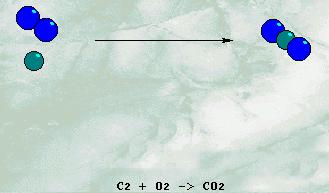
Se l'Ossigeno scarseggia, come succede quando una
stufa o fornello hanno un tiraggio difettoso, si forma Ossido di
carbonio ( CO ) :
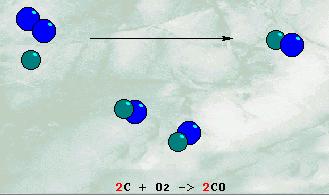
gas VELENOSISSIMO anche in piccole tracce, molto pericoloso
poiché, essendo inodoro ed incolore, non viene riconosciuto dai nostri
sensi e perciò non ci dà possibilità di difesa.
L'Anidride carbonica viene utilizzata per fabbricare bevande
gasate, estintori e per produrre il ghiaccio secco per la conservazione
dei gelati.
Fino alla prima metà del secolo scorso, gli scienziati ritenevano
fermamente che tutte le sostanze presenti negli esseri viventi, animali
e piante, avessero una composizione e una struttura tali da non poter
essere riprodotti in laboratorio. Questa teoria venne smentita nel
1828 dal chimico tedesco WOHLER che riuscì a preparare in laboratorio
l'UREA, sostanza di rifiuto presente nell'urina di molti animali fra
cui l'uomo.
Cadde così la convinzione che fosse impossibile preparare sostanze
simili a quelle che vengono prodotte dagli
esseri viventi. Molti scienziati, da quel momento, si dedicarono
allo studio approfondito delle sostanze costituenti gli organismi viventi
(SOSTANZE ORGANICHE) e cercarono di riprodurle in laboratorio ottenendo
successi notevoli e dando inizio così a una nuova scienza: LA CHIMICA ORGANICA.
Poiché la maggior parte delle sostanze organiche contiene Carbonio insieme
a pochi altri elementi quali Idrogeno,
Ossigeno, Azoto e Zolfo, si può affermare che questa nuova scienza studia i
composti del Carbonio.
IDROCARBURI
Sono costituiti da CARBONIO e IDROGENO e sono numerosissimi
perchè gli atomi di Carbonio hanno la proprietà di legarsi fra
loro a formare lunghe catene (fino a 70 atomi di Carbonio).
ALESSANDRO VOLTA nel 1776 osservando le bolle gassose che affioravano
in una zona paludosa vicina a Como, raccolse questo gas e lo chiamò
"gas delle paludi". Usando una caffettiera di porcellana piena
di questo gas che è infiammabilissimo, costruì la prima lampada a gas.
Nelle miniere si forma spesso una miscela di aria e metano detta "grisou"
che essendo fortemente esplosiva, provoca terribili sciagure.
Altri Idrocarburi sono: ETANO, PROPANO, BUTANO, PENTANO, ESANO, ecc.
ETANO,PROPANO,BUTANO sono gassosi come il METANO e trovano impiego
come combustibili in cucina o nel riscaldamento degli ambienti.
Grandi quantità di questi gas si ricavano come sottoprodotti
dalla lavorazione del petrolio.
I composti con più di 4 atomi di Carbonio sono LIQUIDI fino al
composto con 15 atomi di carbonio (PENTADECANO
C15H32)
H
H
H
H H
H
H
H H
H
|
| |
| |
|
| |
| |
H--C--H
H--C--C--H
H--C--C--C--H
H--C--C--C--C--H
|
| |
| |
|
| |
| |
H
H H
H H
H
H
H H
H
METANO
ETANO
PROPANO
BUTANO
Metano 
La BENZINA usata per alimentare i motori a scoppio è una miscela di
idrocarburi a sette, otto e nove atomi di Carbonio.
L'OLIO LUBRIFICANTE è formato da idrocarburi liquidi che hanno la
molecola formata da un maggior numero di atomi di Carbonio.
La maggior parte di questi idrocarburi si ricava dalla DISTILLAZIONE
FRAZIONATA del petrolio grezzo. Il petrolio viene riscaldato alla
temperatura di circa 400 °C; si trasforma in vapore che passa attraverso
una colonna a piatti. Dalle varie sezioni della colonna si ricavano i
seguenti prodotti: gas combustibili, benzine, cherosene, nafta, oli
lubrificanti, paraffina e asfalto che rimangono sul fondo della torre.
CARATTERISTICHE
DELLA SERIE PARAFFINICA,NAFTENICA E AROMATICA
H H
H H H
H H
H
H
H H
|
| | |
| |
| |
| |
|
H--C--C--C--C--C--C--C--C--...ecc...--C--C--C--H
| | |
| |
| | |
|
| |
H H H H
H H
H H
H H
H
-C--C--C-
| |
|
H H
H
la
molecola, quindi, ha una struttura chiusa ad anello con gli atomi di
Carbonio legati fra loro con legami singoli.
La
molecola più semplice di questa serie: il CICLOPROPANO, per poter chiudere
l'anello,
deve avere almeno 3 atomi di Carbonio (con 2 l'anello non si chiude: anche
in geometria il poligono con minor numero di lati è il triangolo)
Esso
ha 3 atomi di Carbonio come nel Propano, ma chiusi ad anello,
la formula
è C3 H6 :
H H
\ /
\/
C
H \ /\
/H
\ /
\ /
C - -
C
/
\
H /
\ H
La
serie AROMATICA o gli idrocarburi aromatici hanno formula generale
Cn
H 2n-6 .
1) la catena degli atomi di Carbonio sia chiusa;
2) alcuni degli atomi di Carbonio siano legati da un doppio legame che
permetta di sostituire gli atomi di Idrogeno mancati nel completamento
dell'orbita esterna.
H
|
C
/ \\
/ \\
Benzene H--C C--H
|| |
C C
/ \
/ \
/
\ / \
H
C
H
|
H
IDRATI
DI CARBONIO
Questo
nome deriva dal fatto che queste sostanze hanno la molecola formata da
Carbonio, Idrogeno e Ossigeno in proporzione costante e precisamente due
atomi di Idrogeno ed uno di Ossigeno (la stessa proporzione che si
ha nell'acqua : H2 O ) per ogni
atomo di Carbonio.
Gli idrati di carbonio sono numerosissimi: i più importanti sono
prodotti dalle piante durante la fotosintesi clorofilliana (la parola
fotosintesi significa sintesi in presenza di luce).
PROTEINE
Sono sostanze quaternarie, perchè sono formate essenzialmente da quattro
elementi: CARBONIO, OSSIGENO,IDROGENO,AZOTO.
Le
proteine sono sostanze presenti in tutta la materia vivente e specialmente
nel nucleo delle cellule, sia vegetali che animali.
Le
piante per mezzo delle radici ricavano dal suolo i sali minerali contenenti
AZOTO (nitrati e sali ammoniacali). Da queste SOSTANZE INORGANICHE
le piante sintetizzano le proteine vegetali, che serviranno
poi ad alimentare gli animali, fornendo loro l'Azoto necessario per
fabbricare le proteine animali.
Il
Carbonio arriva agli esseri viventi per la massima parte
dalla trasformazione dell'anidride carbonica dell'atmosfera in
sostanza organica (AMIDO) operata dalle piante verdi per mezzo della
fotosintesi clorofilliana.
l'acqua
di mare ne ha in soluzione 7 volte tanto.
Le
piante verdi per compiere la funzione clorofilliana ne sottraggono
all'atmosfera quantità così grandi che nel giro di 22 anni
consumerebbero completamente l'anidride carbonica a loro disposizione ,
se questa non venisse continuamente restituita all'aria.
Affinchè l'equilibrio del Carbonio sia mantenuto in natura per permettere che
la vita continui, si ha un ciclo chiuso di questa sostanza :